relation pka et ph – relation pka ka
Différence entre pKa et pH Définition, pKa: pKa est la valeur négative du logarithmique de Ka, pH: pH est la valeur logarithmique de l’inverse de H + concentration, Indication de l’acidité, pKa: pKa indique si un acide est un acide fort ou un acide faible, pH: Le pH …
Influence du pH sur la solubilité de certains composés ioniques – détail Lorsqu’un des ions d’un composé ionique possède des propriétés acides ou basiques le fait d’imposer par exemple en utilisant une solution tampon le pH du milieu dans lequel on dissout ce composé va modifier sa solubilité,
Au-delà du graphe il y a une relation mathématique liant le pH et le pKa En effet le pH se calcule de la manière suivante : Reprenons alors la relation du Ka de tout à l’heure : Prenons le log de cette relation : Comme pKa = -log Ka log Ka = -pKa,
relation en le pka et le pH
e = pH – log [ H0- ] et pH = pKe + log [ H0- ] La relation permettant de calculer le pH à partir de la concentration en ions H0- s’écrit : pH = pK e + log [ H0 – ] On en déduit : [ H0- ] =10 pH– pKe molL-1 4°- Solutions neutre acide basique, Dans une solution neutre: [ H30+ ] éq = [ H0- ] éq ,
Influence du pH sur la solubilité de certains composés
pH et pKa
· Fichier PDF
Réactions des Acides et Bases Avec l’Eau
Le pH est une mesure de la concentration des ions hydrogène dans une solution aqueuse, Le pKa constante de dissociation acide et le pH sont liés, mais le pKa est plus spécifique dans la mesure où il permet de prédire ce que fera une molécule à un pH spécifique, Essentiellement,…
pH, pKa, et l’équation de Henderson-Hasselbalch
La relation devient en introduisant les logarithmes dans la relation du Ka : -log [Ka] = – log [H +] – log[A-]/[AH] → pKa = pH – log[A-]/[AH] d’où la définition du pH en fonction du pKa : pH = pKa + log[A-]/[AH]
Calcul Relation
Comprendre la relation entre le pH et le pKa
Ph et Pka
Pka et ph
relation pka et ph
pH et pKa : définition
· L’égalité Ka =- pKa montre que pKa et Ka varient en sens, La constante de dissociation de l’eau est liée à l’autoprotolyse de l’eau, La relation R1 est valable si la concentration en base conjuguée est négligeable devant celle en acide, soit : pH pKa – 1, Le pH sera donc fixé par la présence en solution de H2S majoritairement,
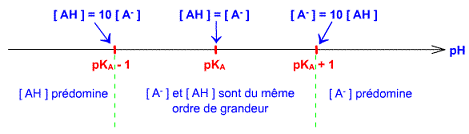
A partir de la relation entre le pH et le pKa, trois zones distinctes de prédominance vont pouvoir être mises en évidence : Cas n°1 : pH = pKa; Si pH = pKa, alors car log1 = 0 Cela signifie donc que les concentrations de l’acide et de sa base conjuguée sont identiques : [AH ] = [A-] Cas n°2 : pH < pKa ; Si pH < pKa, alors d'après les variations de la fonction fx = logx Cela
Cette équation exprime le pH du système en fonction du pKa du couple acide-base considéré et des concentrations respectives en l’acide HA et en la base conjuguée A- On remarque que lorsque les concentrations en l’acide et en la base conjuguée sont identiques le pH du milieu est égal au pKa du couple acide/base , et on se trouve en plein mélange tampon,
Chap VII : Constante d’acidité d’un couple acide/base
· Fichier PDF
Objectifs • Présenter la notion de constante d’acidité d’un couple acide/base • Donner quelques exemples • Donner la relation entre le pH, le pKA et les concentrations des formes acides et basiques, • Expliquer comment bâtir un diagramme de prédominance et comment s&rsquo
Équation de Henderson-Hasselbalch — Wikipédia
Différence entre pKa et pH / Science
· Le pka de l’acide lactique = 3,86 Je dois donc utiliser la relation PKa = PH + log/base conjugé donc l’acide lactique déprotonné /l’acide lactique donc 0,1
| Acide ou Base selon pH/pKa et prédominance des espèces | 25/10/2010 |
| pH à la demi équivalence = pKa | 20/06/2010 |
| dosage phmetrique – Futura |
Afficher plus de résultats
Constante d’acidité et pKA diagramme de prédominance
pH et pKa / domaines d’existencedans l’eau En utilisant le pKa du couple, la relation entre pKa et pH s’écrit : pH = pKa + log [base]/[acide] À pH = pKa → l’acide est à moitié dissociéÀ pH > pKa → l’acide est majoritairement dissociéÀ pH < pKa → l’acide est majoritairement associé
Taille du fichier : 417KB